Δομή και ιδιότητες των μορίων
Όλα τα σώματα που μας περιβάλλουν αποτελούνται από άτομα. Τα άτομα, με τη σειρά τους, συναρμολογούνται σε ένα μόριο. Λόγω της διαφοράς στη μοριακή δομή μπορούμε να μιλήσουμε για ουσίες που διαφέρουν μεταξύ τους, βασιζόμενες στις ιδιότητες και τις παραμέτρους τους. Τα μόρια και τα άτομα βρίσκονται πάντα σε κατάσταση δυναμικής. Ενώ κινούνται, εξακολουθούν να μην διασκορπίζονται σε διαφορετικές κατευθύνσεις, αλλά διατηρούνται σε μια συγκεκριμένη δομή, από ό, τι είμαστε υποχρεωμένοι στην ύπαρξη μιας τόσο μεγάλης ποικιλίας ουσιών στον κόσμο γύρω μας. Ποια είναι αυτά τα σωματίδια και ποιες είναι οι ιδιότητές τους;
Γενικές έννοιες
Αν ξεκινήσουμε από τη θεωρία της κβαντικής μηχανικής, το μόριο δεν αποτελείται από άτομα, αλλά από τους πυρήνες και τα ηλεκτρόνια τους, που αλληλεπιδρούν συνεχώς μεταξύ τους.
Για ορισμένες ουσίες, το μόριο είναι το μικρότεροένα σωματίδιο που έχει τη σύνθεση και τις χημικές ιδιότητες της ίδιας της ουσίας. Έτσι, οι ιδιότητες των μορίων από την άποψη της χημείας καθορίζονται από τη χημική τους δομή και σύνθεση. Αλλά μόνο για ουσίες με κανόνα μοριακής δομής: οι χημικές ιδιότητες των ουσιών και των μορίων είναι οι ίδιες. Για μερικά πολυμερή, για παράδειγμα, αιθυλένιο και πολυαιθυλένιο, η σύνθεση δεν αντιστοιχεί στη μοριακή.
Είναι γνωστό ότι οι ιδιότητες των μορίων δεν προσδιορίζονταιμόνο ο αριθμός των ατόμων, ο τύπος τους, αλλά και η διαμόρφωση, η σειρά της σύνδεσης. Ένα μόριο είναι μια σύνθετη αρχιτεκτονική κατασκευή, όπου κάθε στοιχείο βρίσκεται στη θέση του και έχει τους δικούς του συγκεκριμένους γείτονες. Η ατομική δομή μπορεί να είναι περισσότερο ή λιγότερο άκαμπτη. Κάθε άτομο ταλαντώνεται σε σχέση με τη θέση ισορροπίας του.

Διαμόρφωση και ρυθμίσεις
Συμβαίνει ορισμένα τμήματα του μορίου να περιστρέφονται σε σχέση με άλλα μέρη. Έτσι, στη διαδικασία της θερμικής κίνησης, ένα ελεύθερο μόριο αποκτά παράξενες μορφές (διαμορφώσεις).
Γενικά, οι ιδιότητες των μορίων καθορίζονται από τον δεσμό(τον τύπο του) μεταξύ των ατόμων και την αρχιτεκτονική του ίδιου του μορίου (δομή, μορφή). Έτσι, πρώτα απ 'όλα η γενική χημική θεωρία θεωρεί τους χημικούς δεσμούς και βασίζεται στις ιδιότητες των ατόμων.
Με έντονη πολικότητα, τις ιδιότητες των μορίωνΕίναι δύσκολο να περιγράψουμε δύο ή τρεις σταθερές συσχετίσεις, οι οποίες είναι εξαιρετικές για τα μη πολικά μόρια. Επομένως, εισήχθη μια πρόσθετη παράμετρος με μια στιγμή διπόλου. Αλλά αυτή η μέθοδος δεν είναι πάντα επιτυχής, αφού τα πολικά μόρια έχουν μεμονωμένα χαρακτηριστικά. Επίσης, έχουν προταθεί παράμετροι για τον υπολογισμό των κβαντικών επιδράσεων που είναι σημαντικές σε χαμηλές θερμοκρασίες.
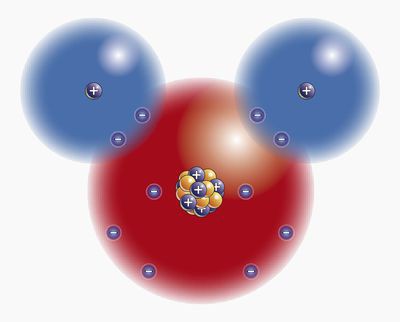
Τι γνωρίζουμε για το μόριο της πιο άφθονης ουσίας στη Γη;
Από όλες τις ουσίες στον πλανήτη μας, το πιοΤο κοινό είναι το νερό. Με κυριολεκτική έννοια, παρέχει ζωή σε όλα όσα υπάρχουν στη Γη. Μόνο οι ιοί μπορούν να κάνουν χωρίς αυτό, άλλες ζωτικές δομές στη σύνθεσή τους έχουν ως επί το πλείστον νερό. Ποιες ιδιότητες του μορίου του νερού, χαρακτηριστικές μόνο του, χρησιμοποιούνται στην οικονομική ζωή του ανθρώπου και στη ζωντανή φύση της Γης;
Μετά από όλα, αυτό είναι πραγματικά μια μοναδική ουσία! Το σύνολο των ιδιοτήτων που είναι εγγενείς στο νερό, δεν μπορεί να καυχηθεί περισσότερο από οποιαδήποτε ουσία.
Το νερό είναι ο κύριος διαλύτης στη φύση. Όλες οι αντιδράσεις που συμβαίνουν σε ζωντανούς οργανισμούς συμβαίνουν με τον ένα ή τον άλλο τρόπο στο υδάτινο περιβάλλον. Δηλαδή, οι ουσίες αντιδρούν όταν είναι σε διαλυμένη κατάσταση.
Το νερό έχει εξαιρετική θερμική χωρητικότητα, αλλά χαμηλόθερμική αγωγιμότητα. Χάρη σε αυτές τις ιδιότητες, μπορούμε να το χρησιμοποιήσουμε ως μεταφορά θερμότητας. Αυτή η αρχή είναι μέρος του μηχανισμού ψύξης ενός μεγάλου αριθμού οργανισμών. Στην πυρηνική ενέργεια, οι ιδιότητες του μορίου του νερού χρησίμευαν ως δικαιολογία για τη χρήση αυτής της ουσίας ως ψυκτικού μέσου. Εκτός από το ότι μπορεί να είναι ένα αντιδραστικό μέσο για άλλες ουσίες, το ίδιο το νερό μπορεί να εισέλθει σε αντιδράσεις: φωτόλυση, ενυδάτωση και άλλα.

Το φυσικό καθαρό νερό είναι ένα υγρό που δεν έχει οσμή, χρώμα και γεύση. Αλλά στο πάχος του στρώματος, μεγαλύτερο από 2 μέτρα, το χρώμα γίνεται μπλε.
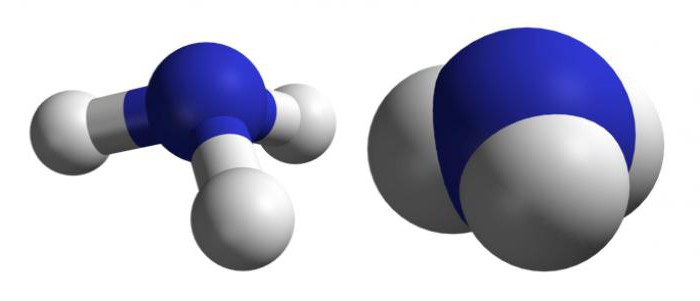
Το όλο μόριο του νερού είναι ένα δίπολο (δύο διαφορετικοί πόλοι). Είναι η διπολική δομή που καθορίζει κυρίως τις ασυνήθιστες ιδιότητες αυτής της ουσίας. Το μόριο του νερού είναι ένα διαμάντι.
Μια άλλη ενδιαφέρουσα ιδιότητα είναι αποψυγμένηνερό: το μόριο του αποκτά μια χρυσή αναλογία και τη δομή της ουσίας - τις αναλογίες του χρυσού τμήματος. Πολλές ιδιότητες που κατέχει ένα μόριο ύδατος προσδιορίζονται με ανάλυση της απορρόφησης και της εκπομπής ραβδωτών φάσεων στην αέρια φάση.
Φυσικές επιστήμες και μοριακές ιδιότητες
Όλες οι ουσίες, εκτός από τις χημικές ουσίες, έχουν τις φυσικές ιδιότητες των μορίων που αποτελούν τη δομή τους.
Στη φυσική επιστήμη, χρησιμοποιείται η έννοια των μορίωνεξηγήσεις των ιδιοτήτων στερεών, υγρών και αερίων. Η ικανότητα όλων των ουσιών να διαχέονται, το ιξώδες τους, η θερμική αγωγιμότητα και άλλες ιδιότητες καθορίζονται από την κινητικότητα των μορίων. Όταν ο γάλλος φυσικός Jean Perrin σπούδασε Brownian κίνηση, πειραματικά απέδειξε την ύπαρξη μορίων. Όλοι οι ζωντανοί οργανισμοί υπάρχουν λόγω της εξαιρετικά ισορροπημένης εσωτερικής αλληλεπίδρασης στη δομή. Όλες οι χημικές και φυσικές ιδιότητες των ουσιών έχουν θεμελιώδη σημασία για τη φυσική επιστήμη. Η ανάπτυξη της φυσικής, χημείας, βιολογίας, και μοριακή φυσική ήταν η εμφάνιση μιας επιστήμη της μοριακής βιολογίας, η οποία διερευνά τις βασικές φαινόμενα στη ζωή.
Χρησιμοποιώντας στατιστική θερμοδυναμική,οι φυσικές ιδιότητες των μορίων, οι οποίες καθορίζουν τις μεθόδους της μοριακής φασματοσκοπίας, καθορίζουν στη φυσική χημεία τις θερμοδυναμικές ιδιότητες των ουσιών που είναι απαραίτητες για τον υπολογισμό της χημικής ισορροπίας και των ποσοστών της εγκατάστασής της.
Ποια είναι η διαφορά μεταξύ των ιδιοτήτων των ατόμων και των μορίων μεταξύ τους;
Πρώτα απ 'όλα, τα άτομα δεν εμφανίζονται σε ελεύθερη κατάσταση.
Σε μόρια, τα οπτικά φάσματα είναι πλουσιότερα. Αυτό οφείλεται στην χαμηλότερη συμμετρία του συστήματος και στην εμφάνιση της πιθανότητας νέων περιστροφών και ταλαντώσεων των πυρήνων. Σε ένα μόριο, η συνολική ενέργεια αποτελείται από τρεις ενέργειες, οι οποίες διαφέρουν κατά σειρά:
- ηλεκτρονικό κέλυφος (οπτική ή υπεριώδης ακτινοβολία).
- ταλαντώσεις πυρήνων (υπέρυθρο τμήμα του φάσματος).
- περιστροφή του μορίου στο σύνολό του (περιοχή ραδιοσυχνοτήτων).
Τα άτομα εκπέμπουν χαρακτηριστικά φάσματα γραμμής, και μόρια - ριγέ, αποτελούμενα από ένα σύνολο γραμμών που βρίσκονται σε απόσταση μεταξύ τους.
Φασματική ανάλυση
Οπτικά, ηλεκτρικά, μαγνητικά και άλλαΟι ιδιότητες του μορίου προσδιορίζονται επίσης από τη σύνδεση με τις λειτουργίες κυμάτων. Τα δεδομένα για τις καταστάσεις των μορίων και η πιθανή μετάβαση μεταξύ τους παρουσιάζουν μοριακά φάσματα.
Οι μεταβάσεις (ηλεκτρονικές) στα μόρια δείχνουντους χημικούς δεσμούς και τη δομή των κελυφών ηλεκτρονίων τους. Τα φάσματα που έχουν μεγαλύτερο αριθμό δεσμών έχουν ζώνες απορρόφησης μεγάλου μήκους κύματος που πέφτουν στην ορατή περιοχή. Εάν μια ουσία κατασκευάζεται από τέτοια μόρια, έχει έναν χαρακτηριστικό χρωματισμό. Είναι όλες οι οργανικές χρωστικές ουσίες.
Ιδιότητες μορίων της ίδιας ουσίαςείναι οι ίδιες σε όλες τις συγκεντρωτικές καταστάσεις. Αυτό σημαίνει ότι για τις ίδιες ουσίες, οι ιδιότητες των μορίων των υγρών, αερίων ουσιών δεν διαφέρουν από τις ιδιότητες των στερεών ουσιών. Το μόριο μιας ουσίας έχει πάντα την ίδια δομή, ανεξάρτητα από τη συνολική κατάσταση της ίδιας της ουσίας.

Ηλεκτρικά Χαρακτηριστικά
Ο τρόπος συμπεριφοράς μιας ουσίας σε ένα ηλεκτρικό πεδίο καθορίζεται από τα ηλεκτρικά χαρακτηριστικά των μορίων: πόλωση και σταθερή διπολική ροπή.
Η στιγμή του διπόλου είναι η ηλεκτρική ασυμμετρία ενός μορίου. Για μόρια που έχουν κέντρο συμμετρίας, όπως το Η2, δεν υπάρχει σταθερή διπολική στιγμή. Η ικανότητα του κελύφους ηλεκτρονίων ενός μορίου να κινηθεί υπό την επίδραση ενός ηλεκτρικού πεδίου, ως αποτέλεσμα του οποίου σχηματίζεται μια επαγόμενη διπολική ροπή σε αυτήν, είναι μια πολωσιμότης. Για να βρούμε την τιμή της πολικότητας και της διπολικής ροπής, είναι απαραίτητο να μετρήσουμε τη διαπερατότητα.
Συμπεριφορά σε εναλλασσόμενο ηλεκτρικό πεδίοτο φως κύματος χαρακτηρίζει τις οπτικές ιδιότητες της ύλης, οι οποίες καθορίζονται από την πολικότητα του μορίου αυτής της ουσίας. Απευθείας με πόλωση είναι συνδεδεμένα: σκέδαση, διάθλαση, οπτική δραστηριότητα και άλλα φαινόμενα μοριακής οπτικής.
Συχνά μπορεί κανείς να ακούσει την ερώτηση: «Τι, εκτός από τα μόρια, εξαρτάται από τις ιδιότητες μιας ουσίας;» Η απάντηση είναι πολύ απλή.
Οι ιδιότητες των ουσιών, εκτός από την ισομετρία και την κρυσταλλική δομή, καθορίζονται από τη θερμοκρασία του περιβάλλοντος, την ίδια την ουσία, την πίεση, την παρουσία ακαθαρσιών.

Χημεία των μορίων
Πριν από τη δημιουργία μιας τέτοιας επιστήμης ως κβαντικήη μηχανική, η φύση των χημικών δεσμών στα μόρια ήταν ένα μυστηριώδες μυστήριο. Η κλασική φυσική δεν μπορούσε να εξηγήσει την κατεύθυνση και τον κορεσμό των δεσμών σθένους. Μετά τη δημιουργία βασικές θεωρητικές πληροφορίες σχετικά με τη χημική συγκόλληση (1927) για ένα παράδειγμα του απλούστερου μορίου Η2, η θεωρία και οι μέθοδοι υπολογισμού σταδιακά βελτιώθηκαν. Για παράδειγμα, με βάση την ευρεία εφαρμογή των τροχιακών μεθόδου μοριακής, κβαντικής χημείας, ήταν δυνατόν να υπολογιστεί η interatomic απόσταση, την ενέργεια των μορίων και οι χημικοί δεσμοί, την κατανομή πυκνότητας ηλεκτρονίων και άλλα δεδομένα, τα οποία μπορεί κάλλιστα να συμπίπτουν με τα πειραματικά αυτά.
Ουσίες με την ίδια σύνθεση, αλλά με διαφορετική χημική δομή και διαφορετικές ιδιότητες, ονομάζονται δομικά ισομερή. Έχουν διαφορετικούς δομικούς τύπους, αλλά είναι οι ίδιοι μοριακοί.
Διάφοροι τύποι δομικού ισομερισμού είναι γνωστοί. Οι διαφορές είναι στη δομή του σκελετού άνθρακα, στη θέση της λειτουργικής ομάδας ή στη θέση του πολλαπλού δεσμού. Επιπλέον, εξακολουθούν να υπάρχουν χωρικά ισομερή στα οποία οι ιδιότητες του μορίου της ουσίας χαρακτηρίζονται από την ίδια σύνθεση και χημική δομή. Επομένως, έχουν τους ίδιους δομικούς και μοριακούς τύπους. Οι διαφορές είναι στη χωρική μορφή του μορίου. Ειδικοί τύποι χρησιμοποιούνται για να αντιπροσωπεύουν διαφορετικά χωρικά ισομερή.
Υπάρχουν ενώσεις που ονομάζονται ομόλογα. Έχουν παρόμοια δομή και ιδιότητες, αλλά διαφέρουν στη σύνθεση από μία ή περισσότερες ομάδες CH2. Όλες οι ουσίες παρόμοιες στη δομή και τις ιδιότητες ενώνονται σε ομόλογες σειρές. Έχοντας μελετήσει τις ιδιότητες ενός ομολόγου, μπορεί κανείς να μιλήσει για οποιοδήποτε άλλο από αυτά. Το σύνολο ομολόγων είναι μια σειρά ομολογίας.
Στον μετασχηματισμό χημικών δομών, χημικώνοι ιδιότητες των μορίων αλλάζουν δραστικά. Ένα παράδειγμα είναι ακόμη και οι απλούστερες ενώσεις: το μεθάνιο, που συνδέεται ακόμη και με ένα άτομο οξυγόνου, γίνεται ένα δηλητηριώδες υγρό που ονομάζεται μεθανόλη (μεθυλική αλκοόλη - CH3OH). Κατά συνέπεια, η χημική συμπληρωματικότητά του και η δράση του στους ζωντανούς οργανισμούς διαφέρουν. Παρόμοιες αλλά πιο περίπλοκες αλλαγές συμβαίνουν όταν τροποποιούνται οι δομές των βιομορίων.
Οι χημικές μοριακές ιδιότητες εξαρτώνται σε μεγάλο βαθμόαπό τη δομή και τις ιδιότητες των μορίων: από τους ενεργειακούς δεσμούς σε αυτό και τη γεωμετρία του ίδιου του μορίου. Ειδικά λειτουργεί σε βιολογικά δραστικές ενώσεις. Τι ένα ανταγωνιστική αντίδραση θα είναι το κυρίαρχο, συχνά καθορίζεται μόνο από τις χωρικές παράγοντες, που εξαρτώνται, με τη σειρά τους, από τα αρχικά μόρια (διαμόρφωση τους). Ένα μόριο που έχει ένα «άβολα» διαμόρφωση, δεν εισέρχεται στην αντίδραση, και ένα άλλο με την ίδια χημική σύνθεση, αλλά μια διαφορετική γεωμετρία μπορεί να αντιδράσει άμεσα σε μία αντίδραση.
Ένας μεγάλος αριθμός βιολογικών διεργασιώνπου παρατηρείται κατά την ανάπτυξη και την αναπαραγωγή, λόγω των γεωμετρικών αναλογιών μεταξύ των προϊόντων αντίδρασης και των αρχικών υλικών. Για την πληροφόρησή σας: η επίδραση μιας σημαντικής ποσότητας νέων φαρμάκων βασίζεται στην παρόμοια δομή μορίων οποιασδήποτε ένωσης που είναι βιολογικά επιζήμια για το ανθρώπινο σώμα. Το φάρμακο παίρνει τη θέση του επιβλαβούς μορίου και περιπλέκει τη δράση του.
Με τη βοήθεια των χημικών τύπων εκφράζουν τη σύνθεση καιιδιότητες των μορίων των διαφόρων ουσιών. Με βάση το μοριακό βάρος, χημική ανάλυση, δημιουργείται μια ατομική αναλογία και καταρτίζεται ένας εμπειρικός τύπος.
Γεωμετρία
Προσδιορισμός της γεωμετρικής δομής του μορίουπαράγεται λαμβάνοντας υπόψη τη διάταξη ισορροπίας των ατομικών πυρήνων. Η ενέργεια της αλληλεπίδρασης των ατόμων εξαρτάται από την απόσταση μεταξύ των πυρήνων των ατόμων. Σε πολύ μεγάλες αποστάσεις η ενέργεια αυτή είναι μηδενική. Όταν τα άτομα πλησιάζουν ο ένας τον άλλον, αρχίζει να σχηματίζεται ένας χημικός δεσμός. Στη συνέχεια, τα άτομα προσελκύονται έντονα μεταξύ τους.
Εάν υπάρχει μια αδύναμη έλξη, τότεο σχηματισμός ενός χημικού δεσμού δεν είναι απαραίτητος. Αν τα άτομα αρχίσουν να πλησιάζουν τις πιο κοντινές αποστάσεις, ηλεκτροστατικές απωθητικές δυνάμεις αρχίζουν να δρουν μεταξύ των πυρήνων. Ένα εμπόδιο στην ισχυρή σύγκλιση των ατόμων είναι η ασυμβατότητα των εσωτερικών κελυφών ηλεκτρονίων τους.

Διαστάσεις
Είναι αδύνατο να δείτε μόρια με γυμνό μάτι. Είναι τόσο μικρά ώστε ακόμη και ένα μικροσκόπιο με μεγέθυνση 1000x δεν θα μας βοηθήσει να τα δούμε. Οι βιολόγοι παρατηρούν βακτήρια 0,001 mm. Αλλά τα μόρια είναι εκατοντάδες και χιλιάδες φορές μικρότερα.
Σήμερα, η δομή των μορίων μιας συγκεκριμένης ουσίαςπροσδιορίζεται με μεθόδους περίθλασης: διάθλαση νετρονίων, δομική ανάλυση ακτίνων Χ. Υπάρχει επίσης δονητική φασματοσκοπία και ηλεκτρονική παραμαγνητική μέθοδος. Η επιλογή της μεθόδου εξαρτάται από τον τύπο της ουσίας και την κατάστασή της.
Το μέγεθος ενός μορίου είναι μια ποσότητα υπό όρους εάνλαμβάνουν υπόψη το ηλεκτρονικό κέλυφος. Το σημείο είναι οι αποστάσεις των ηλεκτρονίων από τους ατομικούς πυρήνες. Όσο μεγαλύτερες είναι, τόσο λιγότερο πιθανό είναι να βρεθούν τα ηλεκτρόνια του μορίου. Στην πράξη, το μέγεθος των μορίων μπορεί να προσδιοριστεί λαμβάνοντας υπόψη την απόσταση ισορροπίας. Αυτό είναι το χάσμα στο οποίο τα ίδια τα μόρια μπορούν να συγκλίνουν όταν συσκευάζονται σφιχτά σε έναν μοριακό κρύσταλλο και σε ένα υγρό.
Οι μεγάλες αποστάσεις τοποθετούν τα μόρια σεέλξη, και μικρές, αντίθετα, στην απέλαση. Επομένως, η ανάλυση ακτίνων Χ των μοριακών κρυστάλλων βοηθά στην εύρεση του μεγέθους του μορίου. Με τη χρήση του συντελεστή διάχυσης, της θερμικής αγωγιμότητας και του ιξώδους των αερίων, καθώς και της πυκνότητας μιας ουσίας σε συμπυκνωμένη κατάσταση, μπορεί να καθοριστεί η τάξη μεγέθους μοριακών μεγεθών.



